产品内容:
| 产品组成 |
100T
|
1000T
|
|
Dual-FIREFLYGLO EX Luciferase Reaction Buffer
|
10ml
|
100ml
|
|
Dual-FIREFLYGLO EX Luciferase Substrate
|
1 vial
|
1vial
|
|
Stop&NANOLIGHT Reaction Buffer
|
10ml
|
100ml
|
|
Stop&NANOLIGHT Substrate (100x)
|
100μl
|
1ml
|
|
说明书
|
1份
|
1份
|
产品简介:
“双报告基因”检测系统通常被用来提高实验精确度,即在一个系统中同时表达和测量两个独立的报告基因。一般来说,实验组报告基因与具体实验条件的影响是相关的,而共同转染的内对照组报告基因则是用来充当校正参数,作为内参提供反应基线。将实验组的结果与内对照组的结果进行约化处理,可降低由细胞存活率或转染效率的差异而导致的结果波动,同时还可消除仪器测定引起的实验误差。因此,双报告基因检测可以通过减少外部影响来获得更可靠的实验数据。
NANO&FIREFLYGLO双萤光素酶报告基因检测系统是一种辉光型定量检测试剂盒,具有高灵敏度和发光信号稳定的特点,符合高通量检测的需求。该检测试剂盒在同一个样品中先以一种新型萤光素为底物来检测萤火虫萤光素酶(Firefly luciferase),后以Furimazine为底物来检测NANOLIGHT萤光素酶,同时淬灭Firefly luciferase的萤光信号,实现双萤光素酶报告基因检测。
相比于辉光型FIREFLY&RENILLALIGHT双萤光素酶报告基因检测试剂盒(MA0520),本品NANO&FIREFLYGLO Luciferase Reporter Assay Kit(MA0522)具有以下优点:采用了全新的萤光素酶检测底物(Furimazine)和NANOLIGHT萤光素酶,具有更高的发光强度,该辉光型试剂盒近乎达到了闪光型双萤光素酶报告基因检测试剂盒(MA0518)的灵敏度;具有更好的发光信号的稳定性,近乎2小时的信号半衰期为实验设计提供了更大的灵活性;高通量检测无需依赖自动进样器,并且无需弃培养液、离心等步骤,简化了实验流程;本试剂盒组分做了大量优化,与传统闪光型产品相比,无明显刺激性气味。NANO&FIREFLYGLO双萤光素酶报告基因检测试剂盒可用于多种常用细胞培养液:RPMI 1640、DMEM 、MEM-α、F12、DMEM/F12等,其半衰期均为2小时左右(22℃),满足绝大多数高通量实验需求。
反应原理如下:

使用说明:
1.自备材料
PBS;多道排枪;白色不透光细胞培养板;化学发光仪或酶标仪。
2.检测前准备
1)首次使用时将Dual-FIREFLYGLO EX Luciferase Reaction Buffer一次性全部倒入Dual-FIREFLYGLO EX Luciferase Substrate瓶中,充分混匀直至所有底物溶解。按使用需求进行分装,建议-70℃长期保存或者短期存放于 -20℃不超过一个月,并尽快使用。
2)Stop & NANOLIGHT Substrate (100x),每次开盖前需进行短暂低速离心。
3)根据实际使用量,以100:1的比例将适量的Stop & NANOLIGHT Reaction Buffer与Stop & NANOLIGHT Substrate (100x)混匀,室温避光备用。例如:如果需要100ml反应液,则需要加入1ml的检测底物。
注:建议现配现用,剩余的含有Furimazine底物的反应液在当次实验结束后,直接舍弃,不要留存。
3.操作方法
1)从细胞培养箱中取出细胞培养板,放置5-15min,恢复至室温。
注:使用白色不透光的细胞培养板,减少孔间的信号干扰。
2)Firefly Luciferase反应检测
a.使用多道排枪向每个细胞孔中加入平衡至室温的含有底物的Dual-FIREFLYGLO EX Luciferase Reaction Buffer,加样体积与细胞培养液体积相同并混匀。由于需要分别加入两种检测溶液,为防止孔板液体溢出,96孔板建议加入80ul培养液,相应加入80ul检测溶液。
b.室温下孵育5-10min。为了使细胞裂解充分,也可将细胞培养板放在振荡混匀仪或附带振板功能的仪器上,室温条件下,采用中高速振板5-10min。
注:孵育时间,可根据细胞量进行适当调整,确保细胞充分裂解,得到稳定的发光检测结果。
c.孵育后于化学发光仪或酶标仪中检测Firefly Luciferase报告基因活性。
注:发光信号会逐渐衰减,为得到最佳检测结果,请在加入检测试剂后2小时内完成检测。
3)NANOLIGHT Luciferase反应检测
a.使用多道排枪向每个细胞孔中加入平衡至室温的含有底物的Stop & NANOLIGHT Reaction Buffer,加样体积与初始细胞培养液体积相同并充分混匀。例如,96孔板建议加入80ul培养液,相应加入80ul检测溶液。
b.将细胞培养板放在振荡混匀仪或附带振板功能的仪器上,室温条件下,采用中高速振板至少3min。使溶液充分混匀,得到最佳淬灭效果。
c.孵育至少10min后(包括前面振板3min)于化学发光仪或酶标仪中检测NANOLIGHT Luciferase报告基因活性。
注:发光信号会逐渐衰减,为得到最佳检测结果,请在加入检测试剂后2小时内完成检测。

注意事项:
1.检测仪器选择:能够检测化学发光的仪器都适用本试剂盒的检测,但是针对相同的样品,不同检测器本底信号值和测量值均可能不同;且对于同一样本检测,不同仪器的数值不可横向比较。为防止孔间干扰,推荐使用不透明白色细胞培养板。
2.由于发光信号会受到检测环境如培养基组分、温度等影响,所以应确保同组内不同样本检测条件一致。
3.酶促反应对温度较为敏感,加样检测前务必将检测试剂以及细胞培养板平衡至室温。
4.NANOLIGHT萤光素酶具有超强信号稳定性,半衰期可达2小时。但是当酶表达量过高时,信号半衰期会缩短,建议优化实验设计方案(如减少质粒转染量),避免萤光素酶表达量过高。
5.为取得最佳检测结果,加入Stop & NANOLIGHT Reaction Buffer后,需要孵育至少10min才可以检测NANOLIGHT Luciferase报告基因活性,其中包括振动混匀至少3min。
保存条件:
全新试剂盒-20℃保存,一年有效。
溶解分装后的Dual-FIREFLYGLO EX Luciferase Substrate于-70℃避光保存一年,或-20℃短期保存不超过一个月。
短期运输条件:
避光冷藏
数据展示

图1. NANO&FIREFLYGLO发光淬灭效果对比P进口品牌。相同浓度的NANOLIGHT、Firefly萤光素酶的体系中,依次加入FIREFLYGLO和Stop&NANOLIGHT反应液,分别记录两者萤光素酶的发光强度以及淬灭情况。由图可知,组的双酶发光强度与P进口品牌基本无差别,并且淬灭效率要高于P进口品牌。

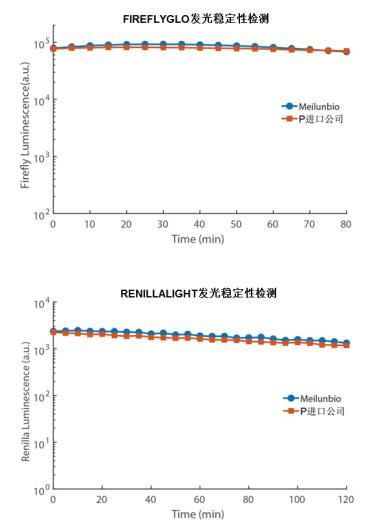
图2. NANOLIGHT/FIREFLYGLO发光稳定性对比P进口品牌。萤光素酶在一定浓度范围内,的NANOLIGHT/FIREFLYGLO的绝对光强与P进口公司非常接近;而且的NANOLIGHT发光稳定性在体外NANOLIGHT酶检测中要好于P进口品牌。

图3. NANOLIGHT/FIREFLYGLO线性范围验证。单一时刻下,NANOLIGHT、FIREFLYGLO萤光素酶浓度-光强标曲线性良好(R2(NANOLIGHT)=0.999;R2(Firefly)=0.999)

图4. NANOLIGHT/FIREFLYGLO在不同培养基发光检测。图中数据分别以各自的RPMI-1640组做归一处理,NANOLIGHT/FIREFLYGLO发光体系在常用培养基:MEMα、F12、DMEM/F12、DMEM、RPMI-1640中都可以正常发光。

图5. NANOLIGHT/FIREFLYGLO酚红耐受能力检测。配制含有酚红浓度梯度的PBS溶液0-20mg/L,每组分别加入等量的NANOLIGHT萤光素酶或萤火虫萤光素酶,再检测NANOLIGHT、FIREFLYGLO 的发光效果。由图可知, NANOLIGHT/FIREFLYGLO对比P进口公司具有更强的酚红耐受能力。

图6. 细胞培养体系中NANOLIGHT /FIREFLYGLO光强稳定性(A)和细胞密度-光强标曲(B)示例。在细胞培养基环境中,原位追踪检测NANOLIGHT和FIREFLYGLO发光。由图可知,NANOLIGHT和FIREFLYGLO萤光稳定性和绝对光强与P进口品牌基本一致;而且,组单一时刻条件下的细胞密度-光强标曲线性良好(R2=0.999(NANOLIGHT);R2=0.996(Firefly))。

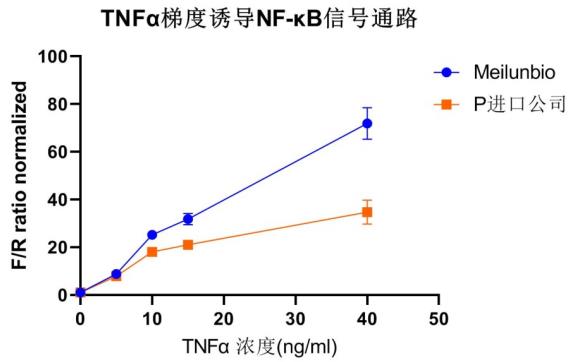
图7. TNFα 梯度诱导NF-κB信号通路检测效果对比P进口品牌。HEK-293T细胞共转染了NANOLIGHT_PEST萤光素酶NF-κB response reporter 和Firefly萤光素酶内参质粒。转染后12h,进行TNFα浓度梯度(0-20ng/ml)诱导5h后,在细胞培养体系内,按照说明书步骤依次孵育并使用酶标仪分别检测双酶的信号读值,并对NANOLIGHT和FIREFLYGLO光强进行约化处理(NANOLIGHT/Firefly)。由图可以明显看出NANOLIGHT /Firefly比值与给药浓度呈正相关,并且组的检测效果与P进口品牌无明显差异。(仪器:BioTek HTX)
我司所售出产品仅供于科研研究用途(非临床科研研究),每次销售产品行为都适用于我司网上所列明的